第1章 がん遺伝子検査(mRNAマイクロアレイ検査)
背景・意義
がんは現在、日本人の2人に1人がかかり、3人に1人が亡くなる身近な病気です。しかし、医学の進歩により、がんは約6割の方が治る時代になりました。特に早期発見・早期治療により、ほぼ100%に近い治癒率を期待できるがんも多くあります。
従来のがん検診では、胃カメラ(胃内視鏡)や大腸内視鏡、CT検査など、検査自体に負担があったり、がんの種類ごとに別々の検査を受ける必要がありました。また、発見される時点では既にある程度進行していることも少なくありませんでした。
そこで注目されているのが「mRNAマイクロアレイ検査」です。この検査は、たった一度の血液検査で、複数種類のがんを同時に、しかも早期の段階で発見できる可能性がある革新的な検査法です。特に、これまで早期発見が困難とされてきた膵臓がんや胆道がんなども検出可能とされています。
がん遺伝子検査(mRNAマイクロアレイ検査)
がん遺伝子検査とはがんを発症しやすい遺伝子を調べる検査ではありません。マイクロアレイという方法の血液検査で、抗体というがん攻撃物質を作る遺伝子(mRNA)の発現のパターンを解析することにより、胃がん・大腸がん・胆道がん・すい臓がんの4種の消化器がんの発症リスクを血液検査で判定できる検査です。国立大学法人金沢大学の研究グループなどによって得られた研究成果を基に開発された検査方法で、98.5%以上の高い精度でがんを早期発見できたと報告されています。
がん細胞を免疫細胞が壊す方法
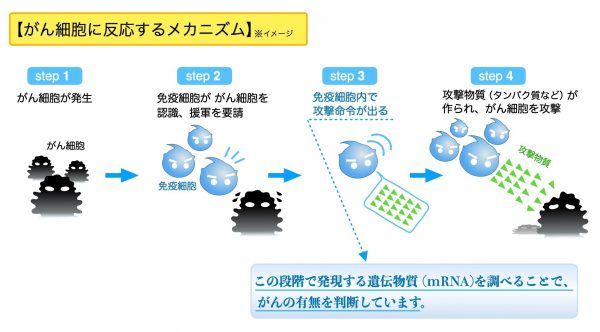
がん細胞が発生すると、免疫細胞ががん細胞を認識するとがん細胞を攻撃する免疫細胞を集める情報を発信します。そして集まった免疫細胞にmRNA(メッセンジャーRNA)という形で、がん細胞を攻撃する抗体の設計図を伝えます。それによってできた抗体ががん細胞に取り付いてがん細胞を壊しています。がん細胞を攻撃する抗体の設計図を含んでいる2,665種類のmRNA遺伝子の発現のパターンを解析する検査で、胃がん・大腸がん・胆道がん・すい臓がんの発症リスクを血液検査で調べることが出来ます。
98.5%の早期がん発見率
金沢大学の研究グループによって得られた研究成果を基に開発されている検査方法で、95%以上の高い精度でがんを早期発見できたと報告されています。実際に胃がん・大腸がん・胆道がん・すい臓がんの人を陽性と判定できた感度は98.5%、胃がん・大腸がん・胆道がん・すい臓がんでない人を陰性と判定できたのも92.9%と高精度の結果が出ています。
プラチナドック
当院で行っている「プラチナドック」には、mRNAのマイクロアレイ検査が含まれていますので、家族にがんが多い方やがんが心配な方、胃カメラや大腸の内視鏡が苦手な方には、お薦めできる検査です。
プラチナドックの詳細は下のボタンをクリックしてください.

mRNAマイクロアレイ検査の仕組みと特徴
検査の基本的な流れ
mRNAマイクロアレイ検査は、採血だけで行える非常にシンプルな検査です。採取した血液から「メッセンジャーRNA(mRNA)」という物質を取り出し、その発現パターンを詳しく調べます。
私たちの体では、がん細胞が発生すると、免疫システムがそれを攻撃しようとします。この時、免疫細胞はがん細胞の存在を感知して、特定のmRNAを作り出します。このmRNAの発現パターンは、がんの種類によって異なる特徴的な「指紋」のような模様を示すことが分かっています。
検査でわかること
現在実用化されている検査では、主に消化器系のがんである胃がん、大腸がん、膵臓がん、胆道がんの4種類について、その発症リスクを判定できます。さらに最新の研究では、血液中のマイクロRNAという別の種類のRNAを解析することで、13種類のがんを高精度で区別できることも実証されています。
検査の優れた特徴
この検査の最大の利点は、採血のみという非侵襲的な方法でありながら、非常に高い検出精度を実現していることです。感度(がんのある人を正しく陽性と判定する割合)は98.5%、特異度(がんのない人を正しく陰性と判定する割合)は92.9%という優れた性能を示しています。
また、従来の腫瘍マーカーが進行がんで陽性率が高くなるのに対し、mRNA検査は症状が出る前の早期がんでも高い検出能力を有します。さらに、一度の検査で複数種類のがんを同時にチェックできるため、時間と費用の効率化も図れます。
従来法との性能比較
以下の表は、本検査と従来の腫瘍マーカー・検診法との早期がん検出力の比較を示したものです。それぞれのがん種で、本検査が従来法を大きく上回る検出感度を持つことが分かります。
表1 従来法との性能比較
| がんの種類(早期病期) | mRNAマイクロアレイ検査 感度 | 従来の検査法 感度 |
|---|---|---|
| 早期胃がん(ステージI) | 約87% | CEA腫瘍マーカー: 約15% |
| 早期大腸がん(ステージI) | 約89% | CEA: 約12% 便潜血検査: 約60% |
| 早期膵臓がん(ステージI–II) | 約85% | CA19-9腫瘍マーカー: 約45% 造影CT: 約70% |
上記より、従来法では早期がんの見落としが多かったのに対し、マイクロアレイ検査では早期でも大部分の症例を捉えられることがわかります。例えば早期大腸がんに対する感度は、本検査が約89%であるのに対し便潜血検査は60%程度、CEAに至っては10数%に過ぎません。膵臓がんでも本検査はステージI?IIで85%程度の感度を示しましたが、従来のCA19-9では半数以上を見逃し(感度45%)、画像検査(造影CT)でも30%近く見逃すと報告されています。このような性能差は臨床的にも大きな意味を持ちます。本検査をスクリーニングに組み込むことで、これまで発見が遅れ手遅れになりがちだったがんを早期に捕捉し、治療成績の向上や生存率の改善につなげられる可能性があります。実際、日本国内10施設で無症状成人5,000人を平均2.5年間追跡した前向き研究では、本検査陽性者の精密検査受診率92.4%、陽性的中率10.0%(陽性者379例中38例のがんを発見)と、健診として十分実用的な有用性が示されました。発見された38例の内訳は胃がん15例、大腸がん12例、膵臓がん7例、胆道がん4例で、その多くがステージIとIIの早期がんであったことも注目すべき点です。以上より、mRNAマイクロアレイ検査は早期発見による予後改善効果が期待でき、今後のがん検診の在り方に大きなインパクトを与える技術と言えます。
検査の適応と注意事項
この検査が特に有用な方
mRNAマイクロアレイ検査は、特に家族にがんの方が多い方、がんが心配だが胃カメラや大腸内視鏡が苦手な方、定期的ながん検診を効率的に受けたい方、症状はないが早期発見を希望する方、従来の検診で異常を指摘されたことがある方におすすめできます。
検査を受ける際の注意事項
この検査を受ける前に、いくつか重要な点を理解しておいていただく必要があります。
まず、この検査はスクリーニング検査であり、診断の確定はできません。陽性の場合は、確定診断のために画像検査や内視鏡検査などの精密検査が必要になります。また、現在の技術では主に消化器系のがんが対象となっており、乳がんや肺がんなど他の部位のがんについては別途検査が必要な場合があります。
非常に高い精度を持つ検査ですが、100%完璧ではありません。偽陽性(がんがないのに陽性となる)や偽陰性(がんがあるのに陰性となる)の可能性もあります。さらに、検査結果だけでは、がんの進行度や治療方針は決まりません。陽性の場合は、必ず専門医による詳しい検査と診断が必要です。
検査結果への向き合い方
検査結果が陽性だった場合でも、必ずしもがんがあるわけではないことを理解することが大切です。良性の病気や炎症性の変化でも陽性となる可能性があります。逆に陰性だった場合でも、検査には限界があるため、症状がある場合や定期的な検診の継続は重要です。
がんと免疫の戦い:
mRNAとは何か??抗体の設計図
まず「mRNA(メッセンジャーRNA)」とは何でしょうか。mRNAは、生体内でDNAの遺伝情報を写し取って作られるタンパク質の設計図のようなものです。細胞はDNAの情報をmRNAに転写し、mRNAの指示に従ってリボソームという細胞内の工場でタンパク質を合成します。実は抗体(免疫が敵を攻撃するためのタンパク質)もこの仕組みで作られます。免疫細胞のひとつであるB細胞が抗体を作るとき、まずDNA上の抗体の遺伝子情報がmRNAに書き写され、それを“設計図”として抗体タンパク質が組み立てられるのです。このようにmRNAは抗体を含むあらゆるタンパク質を作るための設計図であり、体内で必要なタンパク質を生み出す指令書の役割を果たしています。
がん細胞を見つける免疫細胞たち

がんは私たちの体の中で毎日何千個も発生すると言われます。しかし多くの場合、体の防衛システムである免疫がこれらを異物と認識し攻撃・排除してくれます。では、体内にがん細胞が現れたとき、最初にそれをキャッチするのはどのような免疫細胞でしょうか?
まず活躍するのは自然免疫と呼ばれる即応部隊です。例えばマクロファージは体内をパトロールする貪食細胞で、がん細胞のような異常細胞を見つけると直接それを飲み込み(貪食し)、増殖を食い止めようとします。また、NK細胞(ナチュラルキラー細胞)も異常細胞を見分けて即座に攻撃し、がん細胞を排除します。NK細胞はさらにサイトカインという「応援要請」の物質を放出し、他の免疫細胞(T細胞やマクロファージ)を活性化して援軍を呼ぶ役割も担っています。一方で、樹状細胞も体内のあちこちで異物の監視を行う哨戒役の細胞です。マクロファージなどの働きで壊れたがん細胞のがん抗原(がん細胞特有の目印タンパク質)が放出されると、樹状細胞はそれをすばやく取り込みます。このように、がん細胞出現の初動ではマクロファージやNK細胞が直接攻撃しつつ、樹状細胞が“異常発生”の情報をキャッチするのです。
樹状細胞から司令塔T細胞への情報伝達

図は免疫の司令役となる白血球のイメージです。体内で異常ながん細胞が発生すると、まず樹状細胞という免疫細胞がその異常をキャッチします。樹状細胞は「がん抗原」と呼ばれる特徴的なたんぱく質の断片を取り込み、それを自らの表面に掲示する準備を始めます。このとき、樹状細胞内部では抗原を処理するために必要なたんぱく質が大量に作られますが、その設計図となるのがmRNAです。つまり、樹状細胞が正しく情報を提示するためには、裏方でmRNAが休みなく働いているのです。樹状細胞は処理したがん抗原を「主要組織適合遺伝子複合体(MHC)」という舞台装置に載せて提示します。抗原を掲げた樹状細胞はリンパ節へ移動し、待機しているT細胞に「この特徴を持つ異物が現れた」という手配書を示します。T細胞はその手配書をT細胞受容体というアンテナで読み取り、がんの存在を理解します。
情報を受け取ったT細胞は活性化して急速に増殖します。T細胞の中でもヘルパーT細胞(CD4陽性T細胞)は免疫全体の司令塔として働き、樹状細胞から得たがんの特徴をもとに他の免疫細胞に指令を出します。このときT細胞は自らを増やすための合図や、仲間を呼び寄せる「サイトカイン」と呼ばれる信号分子を作り出しますが、これらもすべてmRNAを設計図にして合成されます。T細胞からの指令を受けたB細胞は活性化し、抗体を作り出す「抗体工場」へと変化します。抗体という武器はがん細胞に結合し、他の免疫細胞が攻撃できるよう目印の役割を果たしますが、この抗体を組み立てるためにも大量のmRNAが使われています。つまり、免疫のリレー(樹状細胞→T細胞→B細胞)の表舞台で情報がやり取りされる一方、その裏側では常にmRNAが設計図として働き、武器や合図を作る基盤となっているのです。こうして免疫全体が連携し、がん細胞に対抗する強力な仕組みが成り立っています。
B細胞の奮闘:抗体産生とmRNAの役割
B細胞はリンパ球の一種で、「抗体」というがん攻撃の武器を作り出す重要な役割を担う細胞です。各B細胞はそれぞれ1種類の特異な抗体しか作れませんが、遺伝子の組み換え(V(D)J組換え)や体細胞突然変異などの仕組みにより、身体全体では実に1億種類以上もの多様な抗体のパターンを用意しています。このおかげで、未知の病原体や異常細胞が出現しても、その目印(抗原)にぴったり合う抗体を偶然持つB細胞が体内に存在する可能性が高いのです。樹状細胞とT細胞の働きによってその「当たり」を引いたB細胞が活性化されると、いよいよ抗体産生が始まります。B細胞は増殖して形質細胞(プラズマ細胞)へと分化し、大量の抗体を作り出す抗体工場と化します。
ではB細胞(形質細胞)はどのように抗体というタンパク質を作るのでしょうか? ここで登場するのが冒頭で説明したmRNA(設計図)です。B細胞の中では、抗体タンパク質をコードする遺伝子(DNA)の情報が読み取られ、対応するmRNAが大量に合成されます。このmRNAこそが抗体産生のための設計図です。細胞質に送り出されたmRNAを元に、リボソームがアミノ酸を組み立てて抗体タンパク質が次々と合成されていきます。活性化した形質細胞の働きは驚異的で、1つの形質細胞が1秒間に数千個もの抗体を分泌することも可能です。つまり、それだけ膨大な数のmRNAがコピーされ、フル稼働で抗体生産の指令を出し続けているということです。免疫細胞たちはまさに総力戦で武器(抗体)を量産し、がんとの戦いに備えるのです。
抗体ががん細胞に結合すると何が起こる?

図は抗体(Y字型をした分子)のイメージです。B細胞が産生した抗体は血液中などに放出され、標的であるがん細胞めがけて巡回します。そして抗体の先端部分がカギと鍵穴の関係で特異的に合うがん細胞表面の抗原に結合すると、免疫の攻撃が本格化します。抗体には「敵を無力化する」「敵に目印を付ける」という二つの大きな役割があります。まず、一部の抗体はウイルスや毒素に対する場合と同様に中和作用を持ち、がん細胞の増殖に必要な因子の働きを妨げたり、がん細胞が出す免疫抑制のシグナルをブロックしたりすることがあります。例えば、がん細胞が免疫のブレーキとなるPD-1/PD-L1という分子を利用してT細胞の攻撃を逃れている場合、これを阻害する抗体(いわゆる免疫チェックポイント阻害剤)が結合するとブレーキが解除され、免疫が再び勢いづいてがん細胞を排除できるようになります。
同時に、抗体ががん細胞にくっつくことで「ここに敵がいる!」という旗印が立ちます。するとその旗を認識できる免疫細胞――具体的にはマクロファージやNK細胞といった細胞――が次々と集結してきます。これらの免疫細胞は抗体の尻尾部分(Fc部分)に備わった取手を掴むようにしてがん細胞に結合し、攻撃命令のスイッチを入れます。そして最終的に、がん細胞に取り付いた抗体を目印に、マクロファージががん細胞を貪食したりNK細胞が傷害したりするのです。この一連の攻撃メカニズムはADCC(抗体依存性細胞傷害)と呼ばれ、抗体によるがん細胞排除の重要なプロセスとなっています。抗体ががん細胞をマーキングし免疫細胞を呼び寄せることで、ピンポイントにがん細胞を排除する――まさにチームプレーによる標的攻撃と言えるでしょう。
mRNA測定で「免疫ががんと戦っている証拠」がわかる
以上のように、体内ではがん細胞と免疫細胞の激しい攻防が繰り広げられています。そしてその裏側では、免疫細胞たちが膨大な数のmRNA(設計図)を駆使して攻撃の準備を進めているのです。ここで冒頭のテーマであるmRNAマイクロアレイ検査が登場します。この検査では血液中にわずかに現れる免疫細胞由来のmRNAを網羅的に解析することで、体内で起きている免疫反応のパターンを読み取ります。がん細胞ができると、免疫システムは排除のために特定のmRNAを作ります。このmRNA発現パターンは、がんの種類ごとに特徴的です。言い換えれば、血液中のmRNAを調べれば「免疫がどんな相手と戦っているのか」の手掛かりが得られるのです。実際、mRNAマイクロアレイ検査では“抗体というがん攻撃物質を作る遺伝子”の発現パターンに注目し、そのずれを検出することで胃がん・大腸がん・胆道がん・膵臓がんといった複数のがんのリスクを一度の採血で評価可能と報告されています。免疫細胞は小さながんも見逃さず戦い始めるため、症状が出る前の早期段階であっても、この検査によって体内の「免疫からのSOSサイン」をキャッチできる可能性があります。
がんと免疫の関係、そしてmRNAの役割を見てきました。私たちの体は日々、知らぬ間に免疫の力でがん細胞を抑え込んでいます。その舞台裏では、mRNAという設計図を介した精巧な情報伝達と協働作業が行われているのです。mRNAマイクロアレイ検査は、この免疫の奮闘ぶりを“盗み見”することでがんの存在を見抜く画期的な方法と言えるでしょう。免疫の働きを理解することで、なぜこの検査ががんの早期発見に役立つのか、そのメカニズムがお分かりいただけたのではないでしょうか。そして将来、このような免疫の反応を手がかりにした技術がさらに発展すれば、がんの予防や早期治療にますます大きな力を発揮することが期待されています。私たちの体に元々備わった防衛システムと先端科学の融合が、がん克服への道を照らし出しているのです。
プラチナドックの詳細は下のボタンをクリックしてください.

第2章 疫学と臨床的意義
2.1 早期発見の重要性
がんの早期発見は、患者の予後改善と医療費削減の両面で極めて重要です。日本では年間約100万人が新たにがんと診断され、約38万人ががんで死亡しています。特に膵臓がんや胆道がん、肝臓がんなど消化器系のがんは症状が出にくく発見が遅れがちで、5年生存率が他のがんと比べ著しく低いことが知られています。また従来の臓器別検診では、胃がんなら胃内視鏡、大腸がんなら便潜血+大腸内視鏡、肺がんなら胸部X線+CTといったように多数の検査を個別に行う必要があり、患者の肉体的・経済的負担が大きいものでした。その負担ゆえに検診受診率の低下も課題となっていました。こうした背景から、一度の血液検査で多種類のがんを同時に発見できる多がん早期検出(multi-cancer early detection: MCED)技術として、本検査はがん検診に革命をもたらす可能性があります。
2.2 最新研究から得られたエビデンス
血液中バイオマーカーによる多重がん検出は近年世界的に注目を集めており、日本でも大規模な臨床研究が実施されています。
従来のがん検診は臓器ごとに異なる手法を必要としましたが、MCED(multi-cancer early detection)は、一度の採血で複数種類のがんを網羅的に検出できるという点で画期的です。血液中にはcell-free DNA(cfDNA)、RNA断片、エクソソームに含まれるmiRNAやmRNAなど腫瘍由来分子が存在し、これらのプロファイルを解析することでがん特有の分子シグネチャを抽出することが可能です。特にmiRNAやmRNAは転写レベルでの変化を反映するため、がんそのものだけでなく宿主免疫応答も含めて捉えることができ、早期診断に適したバイオマーカーと考えられています。
日本では国立がん研究センターを中心に、多施設共同研究として世界最大規模の血清miRNA解析プロジェクトが2014年に開始されました。対象は胃、大腸、膵臓、胆道、肺、乳、食道、肝臓、卵巣、子宮体、膀胱、腎、頭頸部の13種類の固形がんで、患者9,921例と健常対照5,643例を登録するという前例のない規模で行われました。血清から小分子RNA画分を抽出し、マイクロアレイで数百種類のmiRNA発現量を同時測定、さらに一部は次世代シーケンサーでバリデーションを行いました。解析にはサポートベクターマシン、ランダムフォレスト、ニューラルネットワークなどの機械学習が用いられ、交差検証法により過学習を回避しました。
2022年に報告された解析結果では、全ステージ横断でのがん種判別精度はAUC 0.88、ステージ0?II(上皮内がん?浸潤初期)に限定してもAUC 0.90という高精度が得られました。ここでいうAUC(Area Under the Curve)はROC曲線下面積を意味し、0.5はランダム分類、1.0は完全識別を示します。一般的にAUC 0.8以上は「良好」、0.9以上は「極めて優秀」と評価されます。したがってAUC 0.88および 0.90という値は、血液検査による多重がん検出法として国際的にも極めて高水準であることを示しています。この結果は、血清miRNA解析が進行がんのみならずごく早期の病変においても有効であることを初めて大規模に証明した重要なエビデンスです。また、がん種ごとに特徴的なmiRNAシグネチャが同定され、がんの有無だけでなく種類の同定も可能であることが明らかとなりました。
別の研究では、消化器4がん(胃・大腸・膵・胆道)の患者67例と健常者14例を対象にmRNA発現プロファイルを比較したところ、感度98.5%、特異度92.9%という極めて高い精度が報告されました。各がん種別でも胃がん96.2%、大腸がん98.1%、膵臓がん99.2%、胆道がん97.4%といずれも90%以上の感度を達成しており、ステージ0で88%、ステージIで91%、IIで93%、III?IVで95%と、早期がんでも高い検出率が維持されました。
従来のCEAやCA19-9などの腫瘍マーカーでは早期がんの大半を見逃していたのに対し、mRNA検査では早期がん患者のわずか1.5%のみが陰性となる結果が得られ、偽陰性が極めて少ないことが示されています。これは従来発見が難しかった消化器がんの予後改善に大きく寄与する可能性を示唆しています。
このように日本発の大規模研究は、miRNA/mRNA解析が世界的なMCED開発競争において独自性と優位性を持つことを示しており、臨床応用と社会実装に向けて極めて重要な基盤データとなっています。
2.3 従来法との性能比較
表1 従来法との性能比較
| がんの種類(早期病期) | mRNAマイクロアレイ検査 感度 | 従来の検査法 感度 |
|---|---|---|
| 早期胃がん(ステージI) | 約87% | CEA腫瘍マーカー: 約15% |
| 早期大腸がん(ステージI) | 約89% | CEA: 約12% 便潜血検査: 約60% |
| 早期膵臓がん(ステージI–II) | 約85% | CA19-9腫瘍マーカー: 約45% 造影CT: 約70% |
例えば早期大腸がん(ステージI)に対する感度は、本検査が約89%であるのに対し便潜血検査は約60%、CEAに至っては10数%に過ぎません。膵臓がんでも本検査はステージI?IIで85%程度の感度を示しましたが、従来のCA19-9では半数以上を見逃し(感度約45%)、画像検査(造影CT)でも約30%近くを見逃すと報告されています。このような性能差は臨床的にも大きな意味を持ちます。本検査をスクリーニングに組み込むことで、これまで発見が遅れ手遅れになりがちだったがんを早期に捕捉し、治療成績の向上や生存率の改善につなげられる可能性があります。実際、日本国内の10施設で無症状成人約5,000人を対象に平均2.5年間追跡した前向き研究では、本検査陽性者の精密検査受診率92.4%、陽性的中率10.0%(陽性者379例中38例のがんを発見)と、健診手法として十分実用的な有用性が示されました。発見された38例の内訳は胃がん15例、大腸がん12例、膵臓がん7例、胆道がん4例で、その多くがステージI?IIの早期がんであったことも注目すべき点です。以上より、mRNAマイクロアレイ検査は早期発見による予後改善効果が期待でき、今後のがん検診の在り方に大きなインパクトを与える技術と言えます。
第3章 分子生物学的基盤と技術原理
3.1 検査の原理的背景
mRNAマイクロアレイ検査を正しく理解するには、その分子生物学的基盤を押さえておく必要があります。本検査は遺伝子発現制御の基本原理であるセントラルドグマ(DNA→RNA→タンパク質)と、がん発生時における宿主側(患者側)免疫応答の分子変化とを組み合わせた理論に基づいています。近年の研究で、がんの成立・進展過程では腫瘍そのものの遺伝子発現変化だけでなく、腫瘍微小環境に存在する免疫細胞や線維芽細胞、血管内皮細胞なども大きく発現パターンを変えることが分かってきました。これらの変化は末梢血中の免疫細胞の遺伝子発現プロファイルにも反映されるため、血液を用いた非侵襲的ながん検出が理論的に可能となっています。すなわち、がんが存在するとき体内で起きる様々な免疫反応・炎症反応のシグナルが、血中RNA(mRNAやmiRNA)の変化として現れるのです。

図1: がん患者における血中RNA発現プロファイル変化の模式図。 がん細胞自身やその存在を感知した周辺細胞が、通常と異なるmRNA/miRNAを分泌・発現することにより、血液中のRNAプロファイルに特徴的な変化(いわば「指紋」パターン)が生じる。
3.2 mRNAとマイクロアレイ技術
メッセンジャーRNA(mRNA)はDNA上の遺伝情報を写し取りリボソームへ運ぶ分子であり、細胞内での遺伝子発現状態をリアルタイムに反映する“設計図”です。mRNAの発現量は転写因子の働きやシグナル伝達経路により動的に変化し、各組織・各細胞ごとに独自の発現プロファイルを示します。また一般にmRNAは分解されやすく寿命が短い(種類にもよりますが半減期が数分?数時間程度)ため、細胞の状態変化が迅速に反映されやすい特徴があります。炎症やがんのような異常状態では、平常時とは全く異なるmRNA発現パターンとなることが知られています。このような末梢血中のmRNA変動を解析することで、臨床的に意味のある情報が得られるという発想が本検査の根幹にあります。
DNAマイクロアレイ技術では、まず検体(本検査では患者血液から抽出したRNA)から逆転写酵素により相補的DNA(cDNA)を合成し、蛍光色素で標識します。あらかじめガラス基板上には配列既知のDNAプローブ(数千?数万種類)がスポット状に高密度に固定配置されており、標識cDNAを反応させると対応する相補的配列のプローブに結合します。次に基板を専用のレーザースキャナーで読み取ることで各スポットの蛍光強度を測定し、どの遺伝子がどの程度発現していたかを網羅的に調べることができます。従来は遺伝子ごとに個別の実験で発現量を調べていたのに対し、マイクロアレイでは一度の試験で数万の遺伝子を同時測定できるため、包括的な発現プロファイル解析が可能となりました。この技術は創薬や疾患研究にも広く用いられており、本検査では特に免疫応答に関連する遺伝子群の発現変動に着目して解析が行われます。

図2: DNAマイクロアレイによる網羅的遺伝子発現解析の流れ(概略)。対象生物の細胞内でDNAからmRNA(赤色)が転写・スプライシングされる。抽出したmRNAは逆転写酵素により安定な二本鎖cDNA(青色)に変換され、断片化して蛍光標識(橙色)される。標識cDNA断片を多数のオリゴDNAプローブが固定されたマイクロアレイ上でハイブリダイゼーションさせ、レーザー走査による各スポットの蛍光強度測定によって、あらかじめ選択された遺伝子セットの発現量を包括的に定量する。
3.3 がん検出の分子メカニズム
がんが体内に出現すると、それに対する生体側の反応は多段階で進行します。まず第1段階では、樹状細胞が腫瘍由来抗原を取り込みリンパ節で提示し、抗原特異的T細胞が活性化・増殖します。同時にB細胞による抗体産生も開始されます。第2段階では、サイトカインやケモカインのネットワークが作動し、腫瘍細胞を排除しようとする免疫応答がさらに活性化します。例えばインターフェロンやインターロイキンなどの炎症性サイトカインが産生され、免疫チェックポイント分子(PD-1/PD-L1など)の発現変化やエフェクターT細胞の腫瘍組織浸潤が起こります。第3段階になると、腫瘍関連マクロファージのM1/M2極性化や癌関連線維芽細胞の活性化、さらには血管新生やリンパ管新生の促進といった慢性的炎症状態・腫瘍微小環境のリモデリングが進行します。そして末期には急性期タンパクの産生亢進や全身性の代謝変調など、腫瘍の存在が宿主全身に影響を及ぼす段階に至ります。
mRNAマイクロアレイ検査では、これら一連の段階で末梢血中の免疫細胞に現れる遺伝子発現変化を捉えることで、がんの存在を間接的に検出します。解析の対象となる遺伝子群は約2,000~3,000種類にも及び、特に以下のような機能カテゴリーに属する遺伝子セットが網羅的に含まれています。
- 免疫応答関連遺伝子: 約800種類。T細胞マーカー(CD3、CD4、CD8、TCR関連分子)、B細胞マーカー(免疫グロブリン重鎖・軽鎖、CD19、CD20)、NK細胞マーカー(パーフォリン、グランザイム、KIRファミリー)、マクロファージ関連分子(CD68、CD163、iNOS、アルギナーゼなど)。
- サイトカイン・ケモカイン関連遺伝子: 約600種類。炎症性サイトカイン(IL-1β、TNF-α、IL-6、IFN-γ)や抗炎症サイトカイン(IL-10、TGF-β、IL-4)、多数のCCL/CXCLケモカインとその受容体(CCR/CXCRファミリー)など。
- 細胞周期・アポトーシス関連遺伝子: 約400種類。細胞周期調節因子(サイクリン各種、CDK/CDKI群)、アポトーシス制御因子(p53、Bcl-2ファミリー、カスパーゼ群)、DNA修復遺伝子(BRCA1/2、MLH1、MSH2、ATMなど)。
- 代謝・血管新生関連遺伝子: 約300種類。代謝酵素(GLUT、HK、PFK、LDHA等)や脂質代謝酵素(FASN、ACLY、SCD1)、血管新生因子(VEGF、FGF、PDGF、Angiopoietinなど)。
こうした多数の遺伝子指標を組み合わせ、機械学習アルゴリズムによって解析することで高精度のがんリスク評価が実現されています。特に研究グループが開発した「HEADモデル」(階層型エンンサンブルDeep Learningアルゴリズム)では他手法を上回る精度が得られており、適切なデータ解析アルゴリズムの選択が検査性能の鍵となることも示されています。
なお近年、本検査と類似のコンセプトで血中マイクロRNA(より短いnon-coding RNA)の解析も盛んに研究されています。血中miRNAはエクソソーム内などで安定に存在し、がん細胞から直接分泌されたり免疫応答に伴って変化したりと複数の経路でがんの存在を反映します。マイクロアレイに加えて次世代シーケンス技術を用いてmiRNAプロファイルを解析する手法では、さらに多くのがん種を高精度に見分ける研究も進められています。実際、前述の国立がん研究センターの研究では得られた大規模miRNAデータおよび解析コードが全世界に公開され、この分野のさらなる発展に資するリソースとなっています。
第4章 診断プロセスと臨床的判断
4.1 包括的診断アプローチ
mRNAマイクロアレイ検査はあくまでスクリーニング検査であり、陽性結果が出てもそれだけで診断確定とはなりません。したがって、この検査結果を適切に解釈し、必要に応じて追加検査を行い最終診断につなげる総合的な診断プロセスが重要です。現代のがん診療では単一の検査結果に頼らず、複数の情報を統合した多職種チーム(MDT)による診断が標準です。本検査もその一要素として位置づけ、他の臨床情報との統合の中で活用すべきものです。具体的には、検査結果の解釈にあたって患者の年齢・性別・既往歴・家族歴・症状・診察所見などを総合的に考慮し、必要ならば内視鏡や画像検査による精密検査に速やかに進みます。本検査は感度が非常に高い一方、特異度は100%ではなく偽陽性・偽陰性の可能性もゼロではないため、慎重かつ合理的な判断戦略が求められます。
4.2 検査前の評価と手順
本検査の有用性を最大限に引き出すには適切な対象者の選択と事前準備が重要です。一般的に推奨される検査対象は、50歳以上の無症状成人(がん検診の推奨年齢層)、あるいは家族歴があるなどリスクの高い40歳以上の方です。また他に、原因不明の消化器症状があるが従来検査では異常がないケース、職業的に発がんリスクの高い環境に長年従事してきた方(化学物質曝露、放射線業務など)、糖尿病・高度肥満・喫煙など生活習慣によるリスクを有する方なども対象として考えられます。一方で検査結果の信頼性が担保しづらいケースでは実施を控えます。例えば妊娠・授乳中の女性、急性重篤疾患の罹患中、直近3ヶ月以内に大手術を受けた後、免疫抑制剤治療中、あるいは既に他の検査でがんが確定診断され治療中の患者さんなどです。これらの場合、免疫状態の大きな変動や治療の影響で偽陰性・偽陽性が増える懸念があります。
また患者さんへの十分な事前説明も不可欠です。検査の目的や有用性だけでなく限界についても理解を得ておく必要があります(偽陽性/偽陰性の可能性、陽性時には追加精密検査が必要であること、費用負担、結果通知までの流れ、検査データの研究利用への同意など)。こうした点を丁寧に説明し、納得と同意を得てから検査を実施します。
検査の実施自体は採血のみで完了する非常に簡便な手順ですが、標準化されたプロトコールに沿った検体取り扱いによって信頼性を確保します。採取後ただちに血液を適切な試薬で処理し、2時間以内に血清と細胞画分を分離・回収、?80℃で冷凍保存します。輸送の際もドライアイス梱包で温度管理し、24時間以内に解析センターへ届ける、といった手順が定められています。検査ラボではRNA品質の評価(RIN値が7.0以上かなど)やDNA混入チェック、バーコードシステムによる検体取り違え防止、内部標準サンプルによる機器・試薬の品質管理などを徹底し、測定精度と再現性を保証します。
4.3 結果の解釈と対応
検査結果は数値化されたリスクスコアとして提供されます。たとえば総合リスクスコア(0?100の連続値)に加え、胃・大腸・膵臓・胆道それぞれの臓器別リスクが個別に表示されます。さらに統計的信頼性を示す信頼区間や、検体中RNAの品質指標(例えば検体の分解度合いを示す値)なども付記され、多角的な判断材料となります。臨床現場ではこれら数値をいくつかのリスク区分に分類して運用しています。一般的な区分の一例として、以下のようなものがあります。
表1 リスク区分に応じた推奨対応策の例
| リスク分類 | スコア範囲 | 推奨される対応策 (一例) |
|---|---|---|
| 低リスク | 0~25 | 定期検診を継続(次回検査は12~24か月後を目安)。症状出現時は早期受診。 |
| 中リスク | 26~50 | 6~12か月後に再検査を検討。必要に応じ胃内視鏡など追加実施、生活習慣改善指導。 |
| 高リスク | 51~75 | できるだけ早期に精密検査を実施(臓器別スコアに応じて胃内視鏡・大腸内視鏡・CT等)。速やかに専門医を紹介。 |
| 超高リスク | 76~100 | 緊急に精密検査を手配。複数科と連携し、数週間以内に包括的診断および治療開始。 |
上記のようにスコアに応じた層別化戦略に沿って対応策を決定します。陰性(低リスク)であれば「現時点では、がんの可能性が低いがゼロではない」ことを説明しつつ、次回定期検診までの間隔を延ばして経過観察とします。具体的には「症状が出たら結果に関わらず早めに受診すること」「生活習慣の是正(禁煙・節酒・適正体重維持など)を継続すること」を指導し、次の検査は1?2年後を目安とします。中リスクでは、患者の不安に配慮しつつ半年?1年後のフォローアップ検査を提案します。場合によっては上部消化管内視鏡など臓器別の追加検査も検討します。必要に応じて消化器専門医への紹介も視野に入れます。高リスク以上では直ちに精密検査を行う段階です。臓器別スコアで特に高い部位に対応した検査(例:胃スコア高値なら胃内視鏡、大腸なら大腸内視鏡、膵臓なら造影MRIやEUS、胆道ならERCPなど)を優先的に実施します。また複数臓器で同時にリスク高値が示唆される場合にはPET-CTのような全身検索も考慮します。超高リスクの場合は緊急性が高く、2週間以内を目安に必要な検査をすべて終え、診断確定まで持っていく計画を立てます。同時に外科や腫瘍内科など複数科と連携した集学的治療チームを編成し、治療開始の準備も速やかに進めます。
以上のように、mRNAマイクロアレイ検査の結果は適切な文脈で解釈し、それに基づいて迅速かつ過不足のない対応策を講じることで初めて患者さんにとって有益なものとなります。ただ数値を見るだけでなく、その背景にある不確実性(信頼区間など)や患者個々のリスク因子も踏まえて総合判断することが重要です。特に陽性時には患者の不安も大きいため、結果の意味と今後の検査・治療計画を丁寧に説明し、メンタル面のサポートも含めたフォローを行うことが求められます。
第5章 臨床応用と実際の運用
5.1 実装における課題
mRNAマイクロアレイ検査を現実の医療現場に組み込む際には、研究段階で示された高い性能と実地での運用性能とのギャップを最小化することが重要です。どんなに検査技術として優秀でも、医療システムへの適合性や経済性、患者側の受け入れやすさ、医療従事者側の理解促進といった要素が伴わなければ広く普及しません。特に日本の文脈では、公的医療保険の適用可否(現在は自由診療であり費用が高額になる)、地域間の医療アクセス格差、高齢化社会での検診体制の整備、がん診療連携拠点病院との役割分担など、検査導入に際して克服すべき課題が多面的に存在します。これらを踏まえ、段階的かつ戦略的な導入計画と、多職種・多施設の協力体制が必要です。
5.2 段階的実装戦略
本検査の普及に向けては、以下の3段階のステップで段階的に導入を進める戦略が提案されています。
- 第1段階:ハイリスク集団への導入。 初期段階ではまず家族歴がある、遺伝性腫瘍症候群が疑われる、職業上の曝露歴(化学物質・放射線など)がある、喫煙・飲酒・肥満など生活習慣リスクが高い、といった特定の高リスク集団を対象に検査を提供します。主にがん診療連携拠点病院など高度医療機関で施行し、消化器専門医が結果解釈や迅速な精密検査への移行を担当する体制を整えます。この段階で検査の有効性・安全性データを蓄積し、運用上の課題(偽陽性への対処法や陽性時の患者フォロー体制など)を洗い出します。
- 第2段階:地域住民検診への組み込み。 次に自治体が行う住民検診プログラムに組み入れて普及を図ります。具体的には、市区町村の検診車で巡回採血を行える体制整備、結果通知システムの標準化、陽性時に精密検査を受けられる連携医療機関ネットワークの構築などです。地域医師会との連携により、かかりつけ医が検査をオーダーできるよう研修を実施しています。また、結果の解釈支援や専門医紹介システムの整備も行っています。これにより地域医療レベルで広く検査が利用可能となり、住民の検診受診率向上が期待されます。
- 第3段階:全国規模での標準化。 最終的には各専門学会の検診ガイドラインに本検査を位置づけ推奨事項に盛り込むこと、診療報酬上の評価を設定し公的保険適用とすること、検査手順や品質管理基準を全国一律に標準化すること、といった目標を達成します。これらが実現すれば、地域差なくどこでも一定水準の検査が受けられるようになり、本検査が日本全国で標準的な多重がん検診法として定着するでしょう。
5.3 医療機関別の運用モデル
検査を持続的に運用していくには、医療機関の機能に応じた役割分担も重要です。大学病院や基幹病院では、稀少例や陽性症例の精密検査・診断、および検査技術の研究開発、人材教育の拠点としての役割が期待されます。例えば院内に「がん検診外来」を設置し、多職種チームで定期的に検査結果の検討カンファレンスを行い、新たな知見を地域に発信・技術支援する、といったモデルです。地域中核病院では、地域住民への検査提供や一次的な精密検査の実施、かかりつけ医との連携拠点として機能します。具体的には消化器内科・外科が検査を担当し、必要時は放射線科とも連携して画像診断を行い、検査データの品質管理も院内で担うことで地域医療水準の底上げに寄与します。診療所・クリニックでは、住民が気軽に検査を受けられる窓口として採血を行い外部の検査センターに検体を送付する形で本検査を提供するモデルが考えられます。結果説明は必要に応じ専門医と連携して行い、陽性なら速やかに適切な高次医療機関へ紹介するといった橋渡し役を担います。このように各医療機関がそれぞれの強みを活かしつつネットワークを組むことで、検査陽性者へのフォローアップを確実に行い、見逃しを防ぐ体制が構築できます。
5.4 情報システム基盤
全国的な運用を支えるにはITインフラの整備も欠かせません。患者ID管理(バーコードやRFID利用)、検査データの標準フォーマット策定、セキュアな通信網の構築、バックアップ・災害対策、アクセス権限管理などを含む統合的データ管理システムが必要です。また結果通知についても、従来の郵送だけでなく暗号化メール送信や患者用ポータルサイト、スマホアプリ通知など多様な方法を用意し、受診者が確実かつ速やかに結果を得られる工夫が求められます。さらに地域の医療情報連携システム(地域医療ネットワーク)と接続し、検査結果や精密検査所見、治療経過などを主治医間で共有することで、シームレスな患者フォロー体制を実現します。
5.5 実装に関するエビデンス
日本各地ではパイロットプログラムも行われ、実地での有用性データが蓄積されています。例えば2020?2022年にかけ3県6市で実施されたモデル事業では、延べ15,000件の検査を行い平均18ヶ月追跡したところ、検査受診率は目標95%に達し、陽性者の精密検査受診率も87.3%と全国平均(約67%)を大きく上回りました。がん発見数は156例(全受診者の約1.0%)で、費用対効果は従来検診の1.3倍と良好な結果が得られています。また運用面では、検査待ち日数が平均14日(目標15日以内)、結果通知まで7日(目標10日以内)と計画通りに収まり、患者満足度92.1%、医療従事者満足度85.4%と高い評価を得ました。地域格差の分析では、都市部では平均通院時間22分・精密検査体制も充実し陽性的中率11.2%であったのに対し、地方部(人口5万未満)では通院時間47分と長く専門医も非常勤ながら、むしろハイリスク集団が多い地域であったためかがん発見率2.3%、陽性的中率13.1%と都市部を上回る成果も得られました。この結果、移動検診車の活用や遠隔医療による専門医相談、検査センターの物流網整備、遠隔地受診支援制度などが地域格差是正に有効であることが示唆されています。
5.6 医療経済的評価
費用の面でも包括的な分析が行われました。試算では陽性者一人あたりの平均精密検査費用は約21万円でしたが、早期発見による治療費節減効果は1例あたり平均68万円、進行がんとの治療費差は約120万円と見積もられ、医療費削減効果が大きいことが示されました。さらに早期復職による労働生産性損失の回避や介護負担の軽減、QOL向上による社会的コスト削減効果も相当なものと評価されています。総合的な費用対効果指標であるICER(増分費用効果比)は約108万円/QALYとなり、国際的な許容基準(500万円/QALY以下)を大幅に下回りました。仮に今後保険適用された場合にはICERが約68万円/QALYにさらに改善すると予測されており、国民全体への普及に向けても費用対効果の高い介入となり得ることが示唆されています。
第6章 検査結果の解釈と臨床的対応
6.1 統計学的解釈の重要性
mRNAマイクロアレイ検査の結果を適切に解釈し患者対応につなげることは、患者の予後やQOLに直結する重要なプロセスです。この検査はあくまでスクリーニングツールであるため、得られた数値の臨床的意味を判断するには統計学的な視点と臨床経験、さらに患者個々の背景(リスク因子)の総合考慮が必要となります。特に「事前確率(pre-test probability)」の概念は重要です。同じリスクスコアでも、患者の年齢・性別・家族歴・症状の有無などによって、その陽性結果が示唆するがん存在確率(陽性的中率)は大きく異なります。例えば高齢で明らかな危険因子を持つ人では、同じスコアでもより慎重な対応が必要でしょう。逆に若年でリスク因子の乏しい人では、やや高めのスコアでも過剰検査を避ける判断が働くかもしれません。陰性(低リスク)の場合でも絶対安心とは言えないため、症状がある場合は精査すべきですし、症状がなくても定期的なフォローは推奨されます。「陽性=がん確定」ではなく「陽性=精密検査の適応」と捉え、患者への説明でもその点を強調する必要があります。
6.2 結果レポートの構成と工夫
検査報告書には前述のように総合スコアと臓器別スコア、信頼区間、品質指標などが記載されます。視覚的に理解しやすくするため、例えば信号灯の色分け(緑=低リスク、黄=中リスク、橙=高リスク、赤=超高リスク)でリスク水準が示される工夫もなされています。こうした工夫により、患者自身も自分のリスクがおおよそどの程度か直感的に把握しやすくなります。ただし医師側はその数値の背景にある不確実性もしっかり説明しなければなりません。例えば「緑(低リスク)でも絶対ではない」「赤(超高リスク)でも他疾患の可能性もある」といった点です。数値が一人歩きしないよう、あくまで判断材料の一つであることを伝える必要があります。
6.3 患者背景因子の統合
検査解釈時に考慮すべき患者因子としては、年齢(一般に高齢ほど陽性的中率が上がる傾向)、性別(消化器がんには性差あり)、BMI(高度肥満では軽度の偽陽性率上昇傾向)、喫煙歴(リスク評価への寄与)などがあります。医学的既往では、家族歴(近親者にがんがいれば事前確率が上昇)、良性疾患の既往(例:大腸ポリープや胃潰瘍はスコアに影響しうる)、併存症(糖尿病や慢性炎症はスコア上昇要因)、服用薬剤(免疫抑制剤やステロイド・NSAIDs等は結果に影響しうる)なども重要です。症状や身体所見では、腹痛・体重減少・食欲不振といった消化器症状、黄疸や腹部腫瘤・リンパ節腫脹などの所見、さらに血液検査での炎症反応や肝腎機能異常などの情報を総合評価します。これらを踏まえ、最終的なリスク層別化と対応策の決定に至ります。
前章で示したようなリスク区分に応じ、層別化された対応戦略が採られます。低リスク群(緑)では「現時点でがんの可能性は低い」と説明しつつ、「100%ではないので定期検査は継続すること」「何か症状が出たら検査結果に関わらず早めに受診すること」を強調します。具体的には次回検査を1?2年後とし、生活習慣の改善(禁煙・節酒・適度な運動等)を推奨します。中リスク群(黄)では、不安のケアに留意しつつ半年?1年後のフォローアップを提案します。場合によっては胃内視鏡など臓器別の追加検査も検討します。必要に応じて消化器専門医への紹介も考慮します。高リスク群(橙)では速やかに精密検査を行う段階です。臓器別スコアで特に高い部位に対応した検査(胃なら胃内視鏡、大腸なら大腸内視鏡、膵臓なら造影CT/MRI、胆道ならERCPなど)を優先的に実施し、複数臓器でリスク高値ならPET-CTも視野に入れます。超高リスク群(赤)では緊急対応領域であり、2週間以内を目安に全ての必要検査を終えて診断確定まで持っていきます。同時に外科・腫瘍内科・放射線科・病理などと連携した集学的治療チームを編成し、治療開始の準備も並行して進めます。
以上のように、リスクスコアはあくまで意思決定支援ツールであり、それ自体が目的ではありません。スコアを適切な文脈で解釈し、速やかに次の医療行為につなげてこそ患者にとって価値が生まれます。陽性時には特に患者の不安が大きいため、今後の精密検査計画や治療方針を具体的に示し、必要な心理的サポートも提供します。一方、陰性時でも「検査が100%ではないこと」「症状が出た場合は再度受診すべきこと」を説明し、過信による油断を防ぎます。常に患者個々の状況を踏まえ、真陽性を逃さず偽陽性による不利益を最小化するバランスの取れた対応が求められます。
第7章 今後の技術発展と研究動向
7.1 技術革新の方向性
mRNAマイクロアレイ検査技術は目覚ましい速度で進歩しており、現在の限界を克服してさらに高精度・高包括的ながん検出システムへと発展することが期待されています。特に次世代シーケンシング(NGS)や人工知能(AI)、バイオインフォマティクスの進展により、従来のマイクロアレイを超える新しいアプローチが次々と登場しています。また単一細胞解析や液体生検、マルチオミクス統合解析なども組み合わされ、早期発見だけでなく悪性度評価や治療方針の予測、治療効果モニタリングまで含む包括的診断が将来的に可能になると見られています。
今後特に注目される技術開発のロードマップをまとめると以下の通りです。
次世代シーケンシング技術の導入: 従来のマイクロアレイに代わりRNAシークエンス(RNA-seq)を用いることで、約20,000に及ぶ全転写産物を網羅的に解析可能となります。これにより新規バイオマーカー遺伝子の発見やスプライスバリアントの検出、ウイルス関連がんの捕捉、希少がん種の同定など、更なる精度向上が期待されます。デジタルカウント方式であるため定量精度も高く、微小な発現変動も検出しやすくなります。
単一細胞解析の展開: 血液中の1細胞単位で遺伝子発現を解析できるシングルセルRNA-seqが実用化されつつあります。これにより、ごく少数しか存在しない循環腫瘍細胞(CTC)の検出や、各免疫細胞の個別の活性状態の評価が可能となります。近い将来、シングルセル解析によってさらに高感度な早期がん検出や、転移リスクの評価、治療抵抗性クローンの検出などが実現しうるでしょう。
人工知能(AI)の高度統合: 現在用いられているHEADモデルを超える新世代AIアルゴリズムの開発も進んでいます。Transformerアーキテクチャやグラフニューラルネットワークの活用、少数例から学習できる弱教師あり学習、複数施設のデータをプライバシー保護下で共有して学習するフェデレーテッドラーニング(Federated Learning)などにより、さらなる精度向上が図られています。将来的にはAUC 0.95以上、早期がん感度95%以上、偽陽性率5%以下、がん種識別精度98%以上といった驚異的な性能目標も視野に入っています。またAIの説明可能性(XAI)にも注力され、どの遺伝子が診断に重要かを可視化したり、過去の類似症例を提示したりする仕組みにより医師の納得感を高める努力もなされています。
ナノテクノロジーとPOCT: 検査機器自体の小型化・高感度化も重要なトレンドです。ナノ粒子やマイクロ流体デバイス、SPR(表面プラズモン共鳴)センサー、電気化学センサー等のナノテクノロジーを応用した新しい測定デバイスが開発されています。これらにより、従来は大型装置が必要だった高感度検査を手のひらサイズの装置で行える可能性があります。いわゆるPOCT(Point-of-Care Testing)としてクリニックや往診先でも即座に結果が出せるシステムが実現すれば、検体輸送を待つことなくその場でリスク評価ができ、患者の利便性向上に直結します。
国際的研究協力と標準化: 日本発のこの技術も世界的に見れば類似のMCED技術と競争・協調関係にあります。他国との共同研究により、人種・民族差を考慮したグローバルデータベースの構築や、希少がん種について症例を国際集積するといった試みも始まっています。また新技術の社会実装を促進するための規制科学(Regulatory Science)の発展も重要です。AIを用いた診断システムの承認基準作り、国際的な品質管理基準やデータ共有ルールの策定、知的財産の保護枠組みなど、技術革新を安全かつ迅速に医療へ取り入れるためのルール作りが各国で議論されています。
7.2 社会実装への展望
新技術の普及により、将来的には医療格差の解消にも寄与できると考えられます。遠隔地でも受けられるテレメディシン診断や低コスト化による検査普及、熟練検査技師が少ない地域でも遠隔支援で精度を担保する仕組みなど、医療リソースの効率的配置が可能になるでしょう。また精密ながんリスク評価に基づく予防医学の推進も期待されます。個々人に応じた予防策の提案(生活習慣の改善、適切なサプリメント摂取や運動プログラムの指導など)や、ハイリスク者へのサーベイランス強化によって、「がんを発症させない未来」を目指すことも夢ではありません。医療経済的にも、検査コストの低減と早期発見による高額治療の回避によって国全体の医療費負担が軽減し、患者のQOL向上と社会復帰率の改善と相まって莫大な便益をもたらす可能性があります。
欧州臨床腫瘍学会(ESMO)の展望では、「今後5年間で多種類がん早期発見検査によって救える患者が飛躍的に増えるため、診断・治療インフラや人材の拡充が必要になる」と指摘されています。誰を対象にいつ・どこで検査を行うか、膵臓がんなど従来は手遅れで見つかったがん患者の診断治療をどう変えていくか、といった具体策について今まさに国際的な議論が進んでいます。日本でも、科学的エビデンスに基づく慎重な評価を行いつつ、社会がこの技術を受け入れるための環境整備が求められるでしょう。
以上、mRNAマイクロアレイ検査を取り巻く技術開発の方向性と将来展望を概観しました。この革新的検査が実用化され普及すれば、がん検診のパラダイムは「発見」から「予防」へ、治療医学から「先制医療」へと大きく転換する可能性があります。そしてがんによる死亡率の飛躍的低下と、患者・家族の生活の質向上という恩恵がもたらされることが期待されます。本検査はまさに新時代の幕開けを告げる技術であり、患者さん・医療者・社会全体にとって大きな希望の光となるでしょう。
医療法人社団彰考会
あいざわクリニック
会沢昌倫
プラチナドックの詳細は下のボタンをクリックしてください.
